2022. 2. 19. 08:00ㆍ리포트/제약ㆍ바이오

안녕하세요. 케이입니다.
방문해 주셔서 감사합니다.😊
코로나19라는 특이상황 속에서 mRNA라는 기술을 기반으로 최초의 백신이 개발되었고, 상용화되어 제약바이오산업에서 게임 체인저로 자리 잡았습니다. 관련해 RNA 기초와 산업을 소개한 산업리포트입니다.
아래 링크 클릭 시 해당 위치로 이동합니다.
Part I. RNA 기초 다지기: mRNA
글로벌 제약바이오시장은 RNA에 집중
코로나19 이전부터 신기술로서 주목받아왔던 siRNA 와 mRNA는 대표적인 RNA 기반의 기술로, 코로나19로 인해 상업화가 빠르게 진행되며 이제는 우리에게 너무나 익숙한 기술이 되었다. 그동안 희귀질환에 국한되어있던 RNA기반의 기술들이 점차 만성질환까지 확대되고 있으며 우리의 영원한 숙제, 항암분야와 뇌질환에도 활발한 개발이 이루어지고 있다.
mRNA의 성장은 코로나19 백신에서 시작되어 그 어떤 기술보다 빠른 성장세를 보여주고 있으며 RNAi의 성장은 2018년 첫 신약 승인 이후 시작되었다고 해도 과언이 아니다. 이 두 기술은 제약바이오 업계에서 엄청난 게임체인져로서 빅파마들의 라이선스 딜 타겟으로 주목받고 있다. 근래 1)현금이 많아진 빅파마들이 늘었으며, 2)글로벌 헬스케어 지수의 부진으로 바이오텍이 저렴해져 인수합병도 가능성이 높아졌고, 3)특허만료를 앞두고 있는 신약이 증가헀기 때문에 4)임상 초기단계에 있는 기술/후보물질/파이프라인을 라이선스 계약과 같은 딜이 증가할 것이라는 전망이다. 그리고 그 딜의 매력도는 글로벌 바이오트렌드에 부합했을 때 높아지는 것이다.
라이선스
라이선스 인(License In)은 글로벌 대형 제약 회사들이 가진 경쟁력 있는 기술에 대한 권리를 국내로 들여오는 것을 의미하고, 라이선스 아웃(License Out)은 기술이나 지식 재산권이 들어간 상품의 생산과 판매를 타사에 허가해주는 것을 말한다.
게임 체인저(Game Changer)
시장의 흐름을 통째로 바꾸거나 판도를 뒤집어 놓을 만한 결정적 역할을 한 사람, 사건, 서비스, 제품 등을 가리키는 용어다.
빅파마 (Big Pharma)
단어 그대로 거대 제약회사라는 뜻으로 전 세계 제약 시장에서 막대한 영향력을 행사한다. 이들 빅파마는 크고 작은 인수합병(M&A)과 꾸준한 연구개발(R&D)을 통해 지금의 입지를 다졌다.
바이오테크놀로지 (biotechnology, BT, 생명공학기술)
생물의 유전자 DNA를 인위적으로 재조합, 형질을 전환하거나 생체기능을 모방하여 다양한 분야에 응용하는 기술 즉, 생명 현상, 생물 기능 그 자체를 인위적으로 조작하는 기술이다. 생물체가 가지는 유전·번식·성장·자기제어 및 물질대사 등의 기능과 정보를 이용해 인류에게 필요한 물질과 서비스를 가공·생산하는 기술을 말한다.
파이프라인
제약바이오산업계에서의 파이프라인은 기업에서 연구개발(R&D) 중인 신약개발 프로젝트를 의미한다. 특히 제약산업은 장기투자 업종이라는 점에서 다양한 제품군을 지속적으로 수혈해 줄 수 있는 신약개발 즉, 파이프라인 구축이 중요하다.
코로나바이러스가 이제는 계절성 질환으로 여겨지며 위드코로나가 다시 언급되고 있는 요즘, 2022년은 코로나19이전에 각광받던 기술들이 다시금 붐을 일으키고 있다. 특히, 코로나 백신개발로 상용화가 앞당겨지고, 전 세계적으로 유효성이 확보된 mRNA기반의 기술에 대한 빅파마들의 투자가 예사롭지 않다. RNA 원천기술을 갖고 있는 기업 중 적자 기업이 많기는 하나, 계속되는 파이프라인 승인과 산업의 성장, 그리고 라이선싱 딜 증가로 인해 중장기적으로 산업의 성장성은 매우 클 것이라는 전망이다. 아직은 초기, 신규 모달리티인 RNAi와 mRNA에 대한 업사이드가 크기 때문에, 선제적인 투자가 필요하다는 판단이다.
위드(with) 코로나
확진자 대신 치명률 중심으로 방역체계를 전환한다는 의미다. 코로나19와 공존한다는 뜻.
모달리티 (Modality, 혁신 치료법)
mRNA와 RNAi기술에 대한 개발과 관심이 증가하면서 글로벌 파이프라인 추세도 증가하고 있다. 향후 mRNA, 그리고 RNAi의 치료제의 증가와 후기 파이프라인 개수가 상승함에 따라 CDMO/CMO 산업에서 필요한 생산과정에 대해서도 이해가 필요하며, 관련하여 트렉레코드가 있는 기업들도 파이프라인과 함께 성장할 것이라는 기대다.
CDMO (Contract Development & Manufacturing Orgainzation, 의약품 위탁개발생산)
항체 바이오 의약품 위탁생산(CMO·Contract Manufacturing Organization)과 위탁개발(CDO·Contract Development Organization)을 함께 일컫는 말이다. 세포주를 받아서 생산하면 CMO, DNA로 받아서 세포주를 만든 후 생산까지 하면 CDO다.
CMO (Contract Manufacturing Organization)
의약품을 위탁생산하는 의약품 전문 생산사업을 뜻한다. 즉, 의뢰 받은 의약품을 대신 생산해주는 것을 의미한다. 주로 자체 생산보다 위탁생산을 통해, 효율화를 꾀하고자 할 때 선택하는 방안이다.
트랙레코드 (Track Record, 생산 경험)
RNA 는 무엇인가? (Feat. DNA와 다르다)
DNA는 디옥시리보핵산, RNA는 리보핵산의 약자로 이들을 묶어 핵산이라 한다. 핵산은 여러 개의 뉴클레오티드로 구성된 중합체이며 DNA를 이루는 뉴클레오티드는 디옥시뉴클레오티드, RNA를 이루는 뉴클레오티드는 리보뉴클레오티드이다. 쉽게 말해, DNA는 유전정보인 몸의 설계도를 보관하는 창고인 반면, RNA는 그 설계도를 복사해 오거나, 설계도대로 만드는 데에 필요한 재료를 가져오는 일꾼 역할이다. DNA와 RNA의 가장 큰 차이점은 DNA는 이중가닥인 반면 RNA는 단일가닥이라는 점이다.
DNA (DeoxyriboNucleic Acid, 데옥시리보핵산, 디옥시리보 핵산)
뉴클레오타이드의 중합체인 두 개의 긴 가닥이 서로 꼬여있는 이중나선 구조로 되어있는 고분자화합물이다. 세포 핵에서 발견되어 핵산이라는 이름이 붙게 되었지만 미토콘드리아 DNA와 같이 핵 이외의 세포소기관도 독립된 DNA를 갖고 있는 것이 있다.
RNA (RiboNucleic Acid, 리보핵산)
오탄당의 일종인 리보스를 기반으로 뉴클레오타이드를 이루는 핵산의 한 종류이다. 하나의 나선이 길게 꼬여 있는 구조를 지니며 DNA의 일부가 전사되어 만들어진다. RNA는 단백질을 합성하는 과정에 작용하며 일부 바이러스는 DNA 대신 RNA를 유전물질로 갖기도 한다. 핵염기로 DNA와 달리 티민 대신 우라실을 갖는다.
핵산 (核酸, nucleic acid)
알려져 있는 모든 생명체에 필수적인 생체고분자 또는 작은 생체분자이다. 핵산이라는 용어는 DNA와 RNA를 모두 포함한다. 핵산은 뉴클레오타이드 단위체로 구성되어 있는데, 뉴클레오타이드는 인산, 5탄당, 핵염기의 3가지 구성 성분으로 이루어진 단위체이다. RNA(리보핵산)은 5탄당이 리보스이며, DNA(디옥시리보핵산)은 5탄당이 디옥시리보스이다.
뉴클레오타이드 (nucleotide)
핵산을 구성하는 단위체인 분자이다. 덧붙여, 뉴클레오타이드는 대사(metabolism)에 중추적인 역할을 한다. 그 용량으로 인해 화학적 에너지의 공급자(ATP)이며, 세포 내 신호계 그리고 효소 반응의 중요성분으로도 작용한다.

Central Dogma: 유전자의 중심원리
유전자의 원리는 왓슨과 크릭이 1953년에 DNA의 이중나선 구조를 밝히면서 시작되었다. 그중 중심원리라 칭해지는 Central Dogma(센트럴 도그마)는 유전정보 자체가 DNA부터 RNA를 거쳐 단백질로 전달되는 것을 뜻한다. 센트럴 도그마는 우리가 흔히 아는 유전정보를 담은 물질 ‘DNA’에서 ‘RNA’로 전사되고, RNA에서 단백질로 번역되는 현상을 뜻하며, DNA로부터 생명체들의 생명현상이 어떻게 나타나는지에 대한 분자 수준의 방향성을 밝힌 것이다.
Central Dogma (센트럴 도그마, central dogma of molecular biology, 분자생물학의 중심원리)
1958년 프랜시스 크릭이 제안한 개념으로, 1970년 네이처지에 개정되어 발표되었다. 이 중심원리는 '단백질로 만들어진 정보는 다른 단백질이나 핵산으로 전달될 수 없다'는 의미도 담고 있으며 생명체의 유전 정보가 어떻게 전달되는지를 나타낸다.

DNA 없이도 RNA만으로 유전정보 전달 가능
현생 세포에서는 이전 세대의 정보를 다음 세대로 전달하는 유전물질이 대부분 DNA임에도 불구하고, DNA의 유전정보를 다음 세대로 전달하기 위해서는 반드시 RNA를 거쳐야 하는 것이다. 그렇기 때문에 상당수의 바이러스에서 RNA 자체가 DNA 처럼 유전물질로서의 역할을 한다. 독감 바이러스를 예시로 들어보자면, 독감 바이러스에 감염된 사람은 세포 안에서는 바이러스의 RNA가 자신을 계속해서 복제해내는데, 이중나선인 DNA와 달리 RNA는 한가닥의 나선구조이기 때문에 인체 세포 내로 들어간 RNA는 반대쪽 나선을 만든 다음 자신을 복제해 증폭시킨다. 마치 DNA의 이중나선이 풀리면서 각각 가닥을 주형 틀로 이용해 RNA가 만들어지는 전사(Transcription)과정과 유사하다. 이러한 과정을 통해서 독감 바이러스는 DNA 없이도 RNA의 단일 가닥으로 자신의 유전물질을 후대에 전달할 수 있게 되는 것이다.
전사 (傳寫, 轉寫, transcription)
DNA에 적혀 있는 유전정보를 mRNA로 옮기는 과정이다. RNA 중합효소가 이 과정을 맡는다. 기본적으로는 DNA 복제과정 중 한쪽 부분과 유사하나, 전사 과정에서는 한쪽 가닥만을 정보로 삼아 옮겨적고 RNA가 합성된 이후 DNA는 원상 복구된다.
원핵세포의 경우 전사된 mRNA는 그대로 다음 과정인 번역 과정으로 넘어가게 되나, 진핵세포의 경우 중간에 끼어 있는 인트론을 제거하고 엑손만을 남겨야 하므로 만들어진 mRNA를 가공하는 과정을 거친다. DNA의 한 가닥을 주형으로 하여 RNA를 만들어 내는 것을 DNA-의존적 RNA 중합효소라고 하며, 전사는 이 효소가 담당한다.
RNA world는 RNA 세계 이론으로, 생화학자 월터 길버트가 1986년에 자신의 염기서열(유전정보)을 스스로 복제할 수 있는 RNA 분자가 최초의 생명체였을 것이라고 주장한 것에서 비롯되었다. RNA의 단일가닥 구조가 서열 정보를 전달하기 쉽도록 만들어주며 3차원 형태로 자기조립을 할 수 있다. 자기조립을 할 수 있다는 것은 즉 적당한 환경조건에서 그 자신이 집합하여 생리적으로 의미가 있는 고차 구조를 형성할 수 있는 현상을 뜻한다. 자기조립을 마친 RNA는 효소 작용(ribozyme, 리보자임)까지 가능해져, 단백질을 만들 수 있는 것인데, 이를 토대로 RNA가 최초의 생명체가 아니냐는 추론이 나오기 시작했다.
RNA world (Ribonucleic acid World, RNA 세계)
생명의 분자적 기원이 RNA로부터 비롯되었으며, DNA보다도 RNA가 먼저 유전정보를 담은 물질로 탄생했다는 내용의 가설로, 1962년 알렉산더 리치(Alexander Rich)가 처음 주장하였으며, 그로부터 24년 후 월터 길버트(Walter Gilbert)에 의해 RNA 세계(RNA world)라는 용어가 처음 사용되었다.
염기서열 (Nucleic Sequence, 핵산의 1차 구조, Nucleic Acid Primary Structure)
DNA의 기본단위 뉴클레오타이드의 구성성분 중 하나인 핵염기들을 순서대로 나열해 놓은 것을 말한다. 유전자는 생물의 유전형질을 결정하는 단백질을 지정하는 기본적인 단위로, 지구 상의 모든 생명체들은 염기서열을 통해 단백질을 지정하는 원리를 따른다.
RNA는 DNA의 보조자가 아니다. DNA의 능력이 1)복제와 2)RNA합성에 그친다면, RNA는 다양한 기능을 가진 형태로 존재한다. DNA상에서 하나의 RNA를 만드는 단위를 유전자라고 부르는데, 사람에게는 유전자가 약 10만개정도 존재한다. 그중 RNA를 통해 단백질을 만들어내는 유전자는 3만 5천여 개 정도로, DNA의 유전정보를 단백질로 전달하는 역할을 하는 매개체(설계자)역할을 하는 것이 흔히들 아는 mRNA(messanger RNA)이다.
RNA: 다양한 기능을 가진 설계자
단백질 합성에 관여하는 주요 RNA 이외에 다양한 RNA가 존재한다. 먼저 mRNA는 리보좀이라는 세포 내 구조물에 붙어, tRNA(transfer RNA)의 도움을 받아 단백질을 생산하고, rRNA(ribosomal RNA)는 단백질 합성, 즉 번역이 일어나는 장소인 리보좀을 구성한다. 쉽게 말해, 단백질이 건물이라면 설계자인 RNA, 설계도면을 전달하는 mRNA, 건축물에 필요한 재료를 전달하는 tRNA, 도면에 따라 건축을 완성하는 rRNA가 대표적이라고 할 수 있다. mRNA와 다르게 tRNA와 rRNA는 단백질 생산용 정보를 담고 있지 않아, 논코딩(non-coding) RNA로 불린다.
논코딩RNA(비번역 RNA)의 존재가 대두된 것은 1990년대에 선충의 성장을 조절하는 중요한 유전자가 단백질을 암호화하지 않는 짧은 RNA(논코딩 RNA)를 만들어낸다는 사실이 발견되며 RNA가 정보 전달 매개체에 그치지 않고, 생명현상에서 많은 부분을 조절한다는 사실이 밝혀졌다. tRNA와 rRNA를 포함하여 대표적인 논코딩 RNA로 불리는 miRNA는 일반 RNA에 비해 매우 작다는 의미에서 마이크로가 붙었다.
miRNA는 문제 있는 단백질 생산을 억제하거나 우리 몸에 침입한 바이러스 RNA에 달라붙어 복제를 막기도 한다. 따라서, miRNA는 암세포를 막는 역할을 하기도 한다.

이러한 다양한 RNA의 종류, 특히 가장 대표적인 ‘전사’과정에 직접적으로 관여하는 mRNA, tRNA, rRNA 이외에 전 세계적으로 많은 연구와 투자가 되고 있는 RNA로는 siRNA와 miRNA가 있다. 침묵, 간섭의 유전자 치료제로 각광받고 있는 siRNA와 miRNA는 유전자 발현을 억제하는 대표적인 RNA이다. 일반적으로 유전자를 침묵하거나, 유전자의 발현을 억제/간섭하는 현상과 프로세스 그 자체를 RNAi라 한다. RNAi는 RNA의 종류가 아니라, 타겟 mRNA이 degradation(억제)되어 특정 유전자가 down regulation되는 프로세스를 말하며, 이런 현상을 유도하는 대표적인 RNA에는 miRNA 와 siRNA가 있는 것이다.
down regulation (유전자 발현의 감소)
인트론 miRNA(Intronic miRNA)와 유전자간 miRNA(intergenic miRNA) 모두를 아우르는, 체내에서 발현된 miRNA들은 번역 억제 과정이라든지, 형태 형성(morphogenesis) 시간을 조절하거나 줄기세포와 같이 미분화되거나 불환전하게 분화된 세포 유형을 유지하는 등의 발생 과정을 조절하는 데 가장 중요한 역할을 담당한다. 체내에서 발현된 miRNA가 유전자 발현의 감소에 기여하는 과정이 1993년 C. elegans를 통해 밝혀졌다. 식물에서는 이와 유사한 예로써, 애기장대(Arabidopsis)의 "JAW microRNA"가 식물의 모양을 조절하는 여러 유전자의 조절에 관여한다는 사실이 확인된 바 있다. 식물에서 miRNA에 의해 조절받는 유전자의 대부분이 전사인자들이다. 이들 개체에서의 miRNA 활성은 F-box 단백질뿐만 아니라 전사인자들을 포함하는 핵심적인 조절 유전자(regulatory gene)의 발현을 조절함으로써 전체적인 유전자 간의 연결 고리를 조절하며, 상당히 광범위하다고 할 수 있다. 인간을 포함하는 많은 종에서 miRNA는 종양(tumor) 형성이나 세포주기 조절 장애(dysregulation)의 원인이 되기도 한다. 따라서, miRNA는 종양유전자(oncogene)와 종양억제유전자(tumor suppressor)의 기능 모두를 수행한다고 볼 수 있다.
siRNA는 RNAi 현상을 유도하게 되는 19-27bp 내외의 짧은 이중가닥 RNA를 말한다. 글자 그대로 small interfering RNA, 짧은 뉴클레오타이드를 가진 RNA로 특정 단백질 합성을 방해함으로써 유전자 발현을 조절한다. 현재 가장 대표적인 유전자 치료 신약개발에 중요한 분자로 사용되며 siRNA는 mRNA와 상보적인 결합을 통해 타겟 mRNA가 단백질로 번역되지 못하게 함으로써 RNA 단위에서 유전자 발현을 억제시킬 수 있게 된다. 그러므로 기존의 약물로 치료하기 어려웠던 난치병 치료에 효과적으로 사용되고 있다. 그 예로, 만성질환 최초로 siRNA의 기전을 이용한 노바티스의 렉비오(잉클리시란, 고지혈증 치료제)는 고지혈증을 유발하는 유전자가 전사되어 mRNA를 만들 때에 mRNA와 상보적인 결합을 하여 파괴하고, 단백질 합성을 억제한다. 단백질 합성 자체를 억제시키게 되면, 혈액 속의 콜레스테롤을 매우 적게 감소시킬 수 있다.
bp (base pair, 염기쌍)
핵산을 이루고 있는 염기들 중에 수소 결합(hydrogen bond)이 가능한 두 염기들이 연결된 것을 가리킨다. 왓슨-크릭 염기쌍(Watson-Crick DNA 염기쌍)의 경우 아데닌(A)과 티민(T)의 쌍, 구아닌(G)과 사이토신(C)의 쌍이 있다. RNA의 경우 티민은 우라실(U)로 대체된다. 그 외에 워블 염기쌍이나 후그스틴 염기쌍도 존재한다.
노바티스 인터내셔널 (Novartis International)
스위스 바젤에 본사를 둔 다국적 제약회사이다. 1996년 스위스에서 가장 큰 두 개의 제약, 의료업체인 시바-가이기(Ciba-Geigy)와 산도즈(Sandoz)의 합병을 통해 설립되었으며, 시가 총액과 총 매출액 기준 세계 최대의 제약회사로 꼽힌다.
miRNA는 앞서 말했듯이, 미니 RNA, 마이크로 RNA로, 22개의 리보뉴클레오타이드로 이루어진 작은 RNA이다. miRNA는 siRNA와 기전이 비슷한데, mRNA와 결합함에 따라 특정 단백질 생성을 억제한다. siRNA가 인위적으로 세포내로 도입시켜 RNAi를 유도하는 물질이라면, miRNA는 세포내에 자연스럽게 존재하는 물질로서 RNAi 현상을 유도하여 타겟 유전자의 조절에 관여한다. 즉, 원래 세포 내에서 RNAi 현상 자체를 유도하는 주인공은 miRNA고, siRNA는 인위적으로 밖에서 넣어준 것이라고 볼 수 있다.
RNA 시장 현황
코로나19 이전부터 바이오의약품 시장의 성장과 더불어 유전자치료제, 세포치료제 그리고 RNA 테라피에 대한 투자와 관심이 증가했다. 그러나 코로나19 전후로 RNA 관련 첫 신약/치료제가 개발되면서 관련 산업이 크게 주목받게 되었고 2021년에는 15가지의 RNA 기반의 치료제/약물이 승인을 받았다. 과거 수십년동안 계속되었던 RNA기반의 파이프라인들이 하나둘씩 승인 받고 있는 동시에 RNA기반의 파이프라인은 더 빠른 속도로 증가하고 있다. 신기술의 등장으로, 또 RNA기술이 접목된 치료제의 상용화로 기술의 유효성이 확보되었으며 치료제로서의 가능성이 커지고 있기 때문이다.

2004년을 기점으로 RNA기반의 약물과 파이프라인이 급증하여 2020년에는 500개 이상의 파이프라인이 개발되고 있었다. 그러나 여전히 신규 모달리티이기 때문에 전임상(Preclinical)단계에 대부분의 약물이 개발 중이다.
RNA 기반의 기술을 이용한 파이프라인 중 가장 많이 이용되는 기술은 ‘RNAi’ 기술로, 2018년 최초의 RNAi 치료제인 온파트로(앨나일람)의 등장과 2020-2021년 최초의 만성질환 타겟(고지혈증) RNAi 치료제인 렉비오(노바티스)의 승인으로 유효성과 승인율이 가장 많이 확보된 기술이다. 이에 덧붙여, 코로나19로 빠른 상용화와 성장성이 확인된 mRNA기반의 기술 또한 다양한 적응증을 타겟으로 파이프라인이 개발되고 있다.
앨나일람 (Alnylam)
RNA간섭(RNAi) 원리에 기반해 siRNA(짧은 간섭 RNA) 치료제를 개발하는 바이오텍이다. 막스플랑크 연구소에서 스핀오프해 2002년 설립됐다.

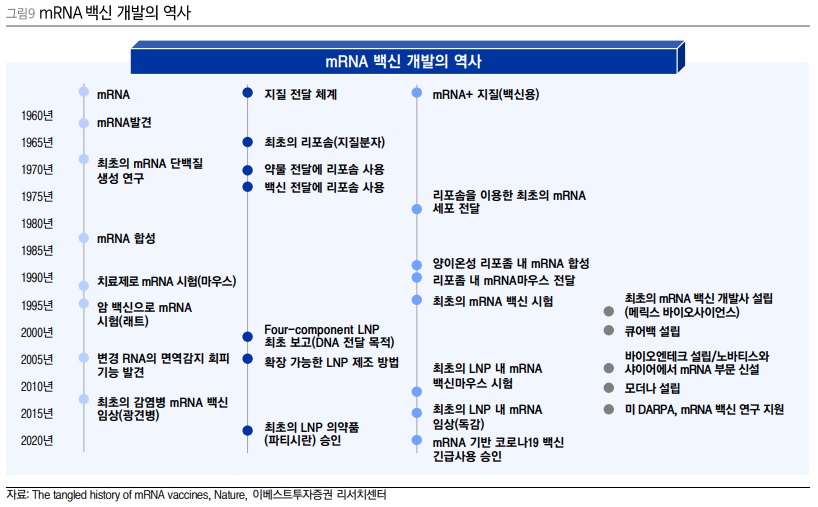
RNA 분야의 new 게임체인져: mRNA (feat. COVID19)
mRNA백신 관련 연구는 1960년대에 시작되어, 1978년까지는 리포솜(liposome)을 이용하여 mRNA를 마우스/인간 세포로 전달해서 단백질 발현을 유도했다. 리포솜이란, 지질(지방)이 만든 구형의 구조체로, 안쪽에 있는 공간에 항암제나 약물을 넣어 전달체로 사용되기도 한다. 그 공간에 mRNA를 넣고, 포장하여 보호한 다음 세포막과 융합해 세포로 전달했던 것이다. 1987년에는 로버트 말론이 분자 실험 중에 mRNA의 단일가닥이 지방 방울과 섞인 혼합물에 인간세포를 담그는 실험을 하다가, 인간세포가 mRNA를 흡수하며 단백질을 생산하기 시작한다는 발견을 했다. 이 발견은 mRNA의 잠재력을 보여주며 의약품으로써의 가능성을 보여주었다. 1988년 말, 말론은 개구리 배아가 mRNA를 흡수하는 실험을 진행하였는데, 이때 살아있는 유기체(생물)에 mRNA를 전달시키기 위해 지방 방울을 섞어 성공시키며 1987년도의 발견이 유의미하다는 것을 다시금 증명해냈다.
그러나, mRNA가 상대적으로 단가가 높아 비싸다는 점과, mRNA가 세포 안까지 들어가는 효율이 낮다는 점, 세포에 들어가더라도 면역 반응이 일어나는 부작용이 발생하기 쉽다는 단점이 있다. 이를 보완하여 2000년대에는 LNP라는 지질나노입자를 개발해내어 세포안까지 안전하고 효율적으로 전달할 수 있게 되었다. 바이오엔테크와 모더나 같은 mRNA 스타트업이 2000년대 후반에 등장하며 많은 관심을 받기 시작했다.
LNP (lipid nanoparticles, 지질나노입자)
mRNA를 나노입자로 전달체에 실어 체내에 주입하는 기술
바이오엔테크 (BioNTech)
독일의 생명공학 기업이다. 2008년에 설립되었으며, 주요 사업 분야는 의약품 개발, 전령 RNA(mRNA) 전용 백신 기술 개발이다. 2020년 코로나바이러스감염증-19 백신을 화이자와 공동 개발하면서 유명세를 탔다.
모더나 (Moderna)
미국 매사추세츠주 케임브리지에 위치한 미국의 바이오테크놀로지 기업으로, 신약 개발, 의약품 개발, 전령 RNA(mRNA) 전용 백신 기술에 초점을 두고 있다.
COVID19백신 중 mRNA기반의 백신이 개발되고 있다는 임상시험 이야기가 나왔을 때, mRNA라는 플랫폼의 백신은 전문가들 에게도 생소하게 느껴졌을 것이다. 코로나 바이러스라는 이례적인 상황에서 최초의 mRNA백신이었음에도 불구하고 막대한 지원과 조치로 약 10개월만에 승인이 되었다고 느껴질 수 있으나, 사실은 30년 이상의 연구가 완성에 다다르기 직전에 코로나바이러스라는 팬데믹이 겹쳐 빠르게 상용화되었을 뿐이다.
임상시험
- 제1상 임상시험
약물의 안전성을 평가하는 것이 목적인 단계이다. 안전성을 평가하고 안전한 복용량 범위를 결정하며 부작용을 식별하기 위해 소규모(일반적으로 20-100명)의 건강한 지원자를 대상으로 시험한다. 앞서 수행된 비임상 시험 단계에서 독성 시험 등 비임상 시험 결과가 유효한 경우, 시험약을 최초로 사람에 적용하는 단계이다. 건강한 지원자 또는 약물군에 따른 적응환자를 대상으로 부작용 및 약물의 체내 동태 등 안전성 확인에 중점을 두고 실시한다.
- 제2상 임상시험
임상시험용 의약품이 기대된 작용기전(mechanism)에 따라 작용되는지 검토하고, 의약품을 사용에 있어서 최적 용량(dose strength)과 투약방법(schedules)을 분석한다. 임상 IIa에서는 약물 후보(연구 중인 질병을 가진 환자 수십 명에서 100명을 대상으로)의 효능에 대한 "개념 증명"을 확립하며, 임상 IIb 단계는 "용량 찾기"(또는 "용량-범위") 단계로, 더 큰 치료 그룹(일반적으로 100–300명)을 대상으로 한 연구에서 안전성에 대한 추가 모니터링과 함께 약물 부작용을 최소화하면서 치료 효과를 나타내는 최적의 용량을 결정하는 단계이다. "소수의 환자들을 대상으로 한 임상시험"이라고 보도되기도 한다.
- 제3상 임상시험
안전성 및 효능의 최종 확인 단계이다. 제3상 임상시험 대규모 환자를 대상으로 하는 시험으로 연구자는 후보 의약품의 안전성과 유효성 및 전체적인 benefit-risk 관계에 대한 통계학적으로 유의한 데이터(significant data)를 만들기 위해서 약 1,000명에서 5,000명의 환자를 대상으로 연구가 실시된다. 이 단계는 의약품으로써 안전성과 유효성 여부 결정의 핵심 단계로서 적정한 의약품 사용을 보증하기 위한 다른 의약품과 상호작용 정보 등 표시사항의 기초가 된다. 임상시험 동안 실생산 규모의 생산계획, 식약청에 품목허가를 받기 위해 필요하고 복잡한 서류 준비 등을 위한 품질 등에 관한 중요한 연구가 많이 수행된다. 유효물질 수준에서 5,000개에서 10,000개의 화합물이 연구개발(R&D)의 파이프라인으로 들어가지만 전임 상단계에서 약 250개의 연구를 거쳐 결국 1개의 승인을 받게 된다. 이러한 신약개발 과정을 거쳐 환자가 이용할 수 있을 때까지 소요되는 기간과 비용은 약 10년~15년의 연구개발기간과 비용은 800백만 달러에서 13억 달러($1.3 billion) 이상으로 추정하고 있다. 대규모로 진행되다 보니 전체 신약개발 비용의 70% 이상이 3상 시험에 소요된다.
- 제4상 임상시험
시판 후에도 장기 투여 부작용 등 안정성 조사, 신 적응적, 부가적인 임상시험 및 약물경제학(Pharmacoeconomics)적 임상시험이다. 임상 4상을 시판 후 조사(PMS, Post Marcket Surveillance)라고 한다. 2년 정도 평가한다.
백신 플랫폼
백신에서 특정 항원이나 유전정보 등만 바꾸어 백신을 개발하는 기반 기술로, 이를 활용하면 백신 개발 기간을 크게 단축할 수 있다. 이러한 백신 플랫폼에는 바이러스벡터 백신, RNA 백신, 재조합 백신, 불활화 백신 등이 있다.
팬데믹 (pandemic, 세계적 대유행)
전염병이나 감염병이 범지구적으로 유행하는 것이다. 이러한 병은 여러 대륙으로 퍼지며, 심지어는 전 지구적으로 퍼진다. 다만 감기와 같이 많은 사람들이 인정한 광범위적 발병 질환은 일단은 범유행병에 해당하지 않으며 이는 풍토병(엔데믹)으로 일컬어진다 또한, 인플루엔자 범유행 중 계절 독감도 범유행에 포함하지 않는다. 역사적인 대규모 범유행은 천연두와 결핵이 있었다. 최근의 범유행적 전염병에는 인간면역결핍 바이러스(HIV)와 2009년 인플루엔자 범유행, 그리고 코로나바이러스감염증-19(COVID-19) 범유행이 있다.

세계 임상시험 정보를 참조할 수 있는 ClinicalTrials.gov에서 mRNA를 검색한 결과 총 1990건의 임상시험이 진행 중이며, mRNA vaccine은 총 289건 진행 중에 있다. 코로나바이러스의 등장이전까지 mRNA는 암 위주의 임상이 가장 활발히 개발 중에 있었으며, 2020년 이후 코로나바이러스와 같은 감염병 위주의 임상시험이 중점이 되었다.
ClinicalTrials.gov
미국 국립보건원(National Institutes of Health, NIH)과 미국 국립의학도서관(National Library of medicine, NLM)이 운영하는 임상시험 정보 사이트이다.
그렇다면 글로벌 빅파마들은 왜 mRNA가 감염병에 가장 적합하다고 생각했을까?
mRNA백신의 가장 큰 장점으로 꼽히는 것은 1)신속성과 2)유연성이다. mRNA백신은 기존 백신처럼 바이러스를 약하게 만들거나 유사한 바이러스를 몸에 투여하는 방식이 아니라 항원 단백질을 만들 수 있는 mRNA를 주입하는 방식이다. 기존의 바이러스 기반의 백신은 바이러스를 대량으로 배양해야 하기 때문에 대량생산이 어려운데 비해 mRNA기반 백신은 바이러스를 대량 배양할 필요도 없고 공정도 복잡하지 않기 때문에 1)제조기간이 짧아 2)단기간에 대량생산이 가능하다. 이러한 장점은 기본에, 바이러스의 유전정보(염기서열)만 알면, 빠르게 설계가 가능하기 때문에 1)초기개발 비용/시간이 적게 들며, 2)변이 바이러스 대응이 쉽다.
2020년 1월 중국에서 코로나바이러스의 유전자 정보가 공개되자마자 mRNA 기반의 플랫폼을 구축해놓았던 모더나와 화이자(바이오엔텍)가 단기간만에 백신을 설계했고 1달만에 임상단계에 들어갈 수 있는 백신을 개발해냈다. mRNA는 바이러스 단백질을 암호화해 이를 합성함으로써 우리 몸에서 똑같은 형태의 단배질을 계속해서 생성해낸다. 그리고 이 단백질들이 감염 위험 없이도 면역체계를 자극해서 반응을 일으키는 것인데, mRNA 서열을 밝혀 내어 유전정보만 갈아 끼우게 되면, 기존 방식같이 단백질 자체를 생성하거나 바이러스를 테스트하는 단계보다 훨씬 수월하게 백신으로 개발이 가능해진다. 우리 몸 자체가 공장이 되어 세포에 들어온 mRNA를 처리하게 되는 것이다.
화이자 (Pfizer)
미국의 제약 회사다. 2020년, 독일 바이온텍사와 코로나바이러스감염증-19에 대한 화이자-바이온텍 코로나19 백신을 공동으로 개발하였다.
RNA바이러스의 특징 (코로나바이러스도 RNA바이러스)
바이러스 중에서도 RNA바이러스는 다른 바이러스 대비 변이가 빠르다. 동물이나 인간의 세포 속으로 침투한 바이러스는 숙주의 유전자를 복제하고 단백질 합성 도구를 사용하여 증식한다. RNA나 DNA는 증식/복제를 하면서 그 과정에서 돌연변이가 발생하기도 하는데, 이중 나선구조로 되어있어 한 가닥에 변이가 일어나 유전정보에 ‘오타’가 나도 ‘수정’이 가능한 반면(원복), RNA는 단일 가닥이기 때문에 유전 정보를 베껴 쓰는 과정에서 조금이라도 복제 과정에서 실수가 일어나 구조가 달라지면 돌연변이가 나와, 변이 바이러스가 된다. 이러한 RNA의 변이율이 높은 특성 때문에, RNA바이러스인 에볼라, 에이즈, 인플루엔자 바이러스 백신이 나오는데 어려움이 있었다. 오타가 난 책을 발간하게 되면, 수정을 하고 재 발간을 해야하기 때문에 처음부터 다시 만들어야 되는 것과 같기 때문이다.

당연히, 복제 과정에서 실수(오타)가 나더라도 무조건 돌연변이 바이러스가 되는 것이 아니라, 돌연변이 중에서 적응에 성공하는 변이 바이러스만이 증식하게 된다. 1)바이러스를 공격하는 항체에 대해 면역이 생겨 항체에 대응이 가능해졌거나, 2)바이러스 자체 복제 효율성이 좋아지는 경우에 ‘성공적인’ 변이라고 판단을 하고 바이러스는 ‘진화’를 하게 된다. 환경에 적응하는 진화 과정을 거친 변이 바이러스는 기존의 바이러스와는 염기서열이 바뀐 상태이다.

mRNA백신 의 확장성: 암
코로나바이러스의 등장 이전, mRNA백신은 주로 항암용으로 개발이 되고 있었으며, 이제는 항암백신에 덧붙여 감염병 중에서도 에이즈와 독감백신 위주로 확장이 되고 있는 추세이다. 모든 질병/질환군중 가장 투자와 관심이 활발한 ‘암’의 암세포는 정상세포의 유전자에 돌연변이가 일어나 만들어지는데, 그 과정에서 단백질 발현 시에 변이가 일어난다. 정상세포와 암세포에는 확실한 차이가 있어, 면역세포가 그 차이점을 인식할 시에 암세포만 선택적으로 제거할 수 있게 된다.
항암 mRNA백신은 1)암환자의 세포조직을 잘라내어, 돌연변이를 분석한 다음, 2)가장암 면역반응이 강할 것 같은 단백질을 찾아내어, 3)맞춤형(개인형) mRNA항암백신을 설계하는 방식이다. mRNA백신이 환자에게 주입되면, mRNA는 종양세포의 돌연변이를 ‘나쁜세포’로 인식할 수 있는 단백질을 생산하라고 지시한다. 그리고 생산된 단백질은 종양세포를 나쁜세포로 인식하고 파괴하기 시작한다.
코로나바이러스 백신의 최대 수혜기업 중 하나인 바이오엔테크는 암세포를 죽이는 11가지 방식을 사용하여 총 21개의 mRNA 항암 백신을 개발중이다. 그중 가장 선두에 있는 파이프라인 중 하나인 ‘흑색종 mRNA백신’은 임상 2상을 진행 중에 있으며, 2021년 11월 FDA로부터 패스트 트랙으로 지정받은 바 있다. 덧붙여, 2021년 10월에는 대장암 mRNA 백신 임상2상도 시작하며 항암백신에 대한 관심을 강조하고 있다. 바이오엔테크 CEO는 mRNA백신으로 항암제를 개발하게 된 이유는 모든 종양이 다르고 개인별 편차가 심하기 때문이라고 언급하며 같은 암 유형을 가진 환자들도 다른 형태의 종양을 갖고 있는 경우가 많기 때문에, 개인화된 치료법이 훨씬 효과적이라는 것을 강조했다.
악성 흑색종 (Malignant melanoma)
멜라닌세포의 악성종양으로서 멜라닌세포가 존재하는 곳에는 어느 부위에서나 발생할 수 있으나 피부에 가장 많이 발생한다. 흑색종은 이 멜라닌세포 또는 기존에 존재하는 모반세포(점을 구성하는 세포)의 악성 형질변환으로 정의할 수 있으며 악성도가 높다.
FDA (Food and Drug Administration, USFDA, 미국 식품의약국)
미국 보건복지부 산하의 식품과 의약품에 대한 관리 규제를 하는 기관이다. 대부분의 식품의 규격과 관련 규제 제정, 영양소 기준, 약품, 백신, 의학 관련 물품, 혈액 관련 물품, 의료 기구, 방사능 측정 기구, 화장품에 이르기까지 다양한 분야의 안전 규칙을 정하는 기관이다. 보건후생성의 하부기관. 이 가운데 의약품에 관계있는 부서가 의약품국이며, 이 밖에 식품·동물의약품·방사선 안전 및 기타 국이 있다. 이에 더해 공중보건활동과 관련 규제 361가지를 통괄하며 보건 상태의 점검 및 필요점, 질병 예방법, 애완 거북이에서부터 의학 기술 분야에 이르기까지 인체의 건강과 관련된 정보를 두루 공공에 제공, 규율한다.
패스트 트랙 (Fast Track)
중증질환 또는 생명을 위협하는 증상들을 적응증으로 하는 신약들의 개발‧심사절차가 신속하게 진행될 수 있도록 하고자 도입된 제도이다. 충족되지 못한 의료상의 니즈에 부응할 수 있을 것이라는 잠재성이 입증된 경우에 한해 제한적으로 지정이 이루어지고 있다.

2022년부터 활발한 라이선스계약으로 mRNA사업부/파이프라인을 확장시키고 있는 화이자 또한 항암분야에 많은 투자를 진행중이다. 2022년 JP모건에서도 초기 임상에 있는 RNA 관련 물질에 대한 선호도를 내세우며 1월 10일에는 빔 테라퓨틱스와 간, 근육, 중추신경계(CNS) 질환을 타겟하는 염기편집 프로그램에 초점을 맞춘 독점 연구협력을 맺으며 mRNA를 확장시키고자 하는 의지를 나타냈다. 화이자 CEO 알버트 불라도 JP모건 2022 발표에서 mRNA가 게임체인져라고 믿으며, 강력한 기술로서 모든 기술을 분석 중에 있다고 밝힌 바 있다.
빔 테라퓨틱스 (Beam Therapeutics)
미국 생명공학기업. 기존 3세대 유전자 가위(크리스퍼) 기술을 보다 정교하게 활용할 수 있는 ‘단일 염기 편집(base editing)’ 기술을 보유했다.
중추신경계통 (central nervous system, CNS)
중추신경계(中樞神經系)라고도 부르며 두개골에 싸여있는 뇌와 척수를 포함하는 신경계로 말초신경계통(Peripheral Nervous System, PNS)과 함께 동물의 행동이나 신체 기작을 제어한다. 척추동물의 중추신경계통은 배아시기 관찰되는 속이 빈 등 쪽 신경삭으로부터 유래하며 이와 같은 특징은 척삭동물의 계통적 특징이다.
JPM헬스케어 컨퍼런스 (J. P. Morgan Healthcare Conference Virtual)
매년 초 미국 샌프란시스코에서 개최된다. 다국적 제약사들이 신약 연구개발(R&D) 성과와 현황을 공유하고, 바이오 시장을 파악할 수 있는 세계적 규모 컨퍼런스이다.
mRNA백신 의 확장성: 독감
모더나의 mRNA-1010은 4종류의 인플루엔자 바이러스를 예방하는 첫 mRNA 기반4가 독감 백신으로 개발중이며, 임상1상을 완료한 바 있다. 항체 지속 기간(약효 지속 기간)이 1년이 안 되는 mRNA 백신의 단점을 보완하여 혼합백신 또한 개발 중에 있다. 그러나, mRNA백신은 생산 기간이 짧아, 독감 유행철에 맞춰 백신 개발이 가능하다는 장점 또한 존재한다. 갑작스러운 독감유행에도 대응이 가능하며, 계절성 독감의 경우, 미국과 계절이 반대인 남반구의 겨울에 실제로 유행한 독감바이러스를 바탕으로 개발되기 때문에 정확도가 높을 수밖에 없다는 판단이다. 모더나의 계절성 독감 백신은 임상 1상 중간결과에서 성인 180명을 대상으로 안전성 문제도 없었으며 백신 접종 후 30일 뒤 면역반응이 확인되었다.
화이자/바이오엔테크 또한 고령층(65~85세)를 대상으로 mRNA 독감 백신 임상시험을 진행 중에 있으며, 사노피는 2021년 8월 인수한 트랜슬레이트 바이오와 mRNA 독감 백신을 개발 중에 있다. 기존의 독감 백신은 예방효과가 낮고(약 55%), 개발이 오래 걸린다는 단점이 있어, mRNA백신이 개발된다면 독감백신으로서도 훨씬 효율적이게 접종이 가능해질 것이라는 판단이다.
사노피 (Sanofi)
프랑스 파리에 본사를 둔 글로벌 제약 기업이다.
트랜슬레이트 바이오 (Translate Bio)
mRNA 신약 개발회사
mRNA백신 의 확장성: HIV
40년이 넘도록 효과적인 백신이 없었던 에이즈(HIV) 바이러스에도 mRNA 연구가 활발히 진행 중이다. 화이자와 모더나의 mRNA 코로나 백신은 코로나 바이러스의 스파이크 단백질을 만드는 유전물질인 mRNA를 인체에 주입하는 방식이었다면, 에이즈 바이러스의 바깥 껍질 단백질과 안쪽 구조 단백질을 만드는 mRNA를 에이즈 백신으로 개발 중에 있다. 백신을 접종하면, 동물의 근육세포가 두 단백질을 결합하여 바이러스 유사입자를 만들고, 바이러스 유사입자는 에이즈 바이러스와 유사한 유전자로 감염이나 질병에 대한 면역반응을 유도할 수 있게 된다. 먼저 쥐실험을 진행한 결과, 두 번의 접종으로 중화항체가 생성되었고, 쥐에서 생성된 단백질은 실제 에이즈 바이러스의 단백질과 매우 흡사했음을 확인했다.
HIV (Human Immunodeficiency Virus, 인간면역결핍 바이러스)
발병하게 되면 AIDS로 진행하는, 인간의 면역체계를 파괴하는 레트로바이러스이다. 기회감염에 의한 사망에 이를 수 있게끔 인간의 면역체계를 무너뜨리는 AIDS를 일으키는 병원체이다.
스파이크단백질 (Spike Glycoprotein, 돌기단백질, 페플로머, Peplomer)
전자현미경을 통해 볼 수 있는 바이러스 외피(viral capsid 또는 viral envelope)에서 바깥으로 돌출된 돌기형태의 단백질을 말하며, 바이러스가 숙주세포의 수용체와 결합할 때 활용된다.
페플로머는 원래 바깥으로 돌출된 외피단백질 전체를 지칭하는 용어였으나 현재는 잘 쓰이지 않으며, 오르토믹소바이러스나 코로나바이러스 등 외피단백질이 크고 눈에 잘 띄는 몇몇 바이러스에 한해 계속 언급되고 있다. 페플로머는 오늘날에는 대부분 돌기단백질(spike protein)이라는 단어로 대체되어가고 있는 중인데, 돌기라는 단어 때문에 뾰족하게 튀어나온 모습을 상상하기 쉽지만 실제로는 끝부분이 둥글거나 납작하거나 단추 모양으로 다듬어져 있는 경우가 많다. 페플로머 또는 돌기단백질은 보이는 형태를 나타낼 뿐으로 막 단백질이나 외피단백질과 동일하진 않으며, 바이러스에서 발견할 수 있는 여러 막 단백질에는 바깥으로 돌출된 부분이 없는 경우도 많다.
이후 원숭이 실험을 진행하여 확실한 전임상 데이터를 확보할 수 있었는데, 원숭이에게 첫 백신을 접종한 후 1년에 걸쳐 부스터샷을 접종한 결과 1)백신 접종 58주 뒤에 12가지 에이즈 바이러스 중화항체 생성, 2)바이러스 감염세포를 공격하는 T세포 반응 유도, 그리고 3)백신 접종 후 60주째부터 1주일에 한 번씩 직장으로 원숭이가 감염되도록 변형시킨 에이즈 바이러스를 주입하며 13주동안 에이즈 감염여부를 확인했으나 7마리 중 2마리는 아예 감염되지 않았고 나머지는 감염이 지연됐다. 2022년 1월말, 모더나의 mRNA HIV 백신(G002)의 임상1상 첫 환자 투여가 시작되며 에이즈 환자들에게 희망을 주고 있다.
부스터샷
백신 효과를 높이고자 일정 시간이 지난 후 추가로 백신을 접종하는 것을 의미한다.
T세포 (T cell, T림프구, T lymphocyte)
항원 특이적인 적응 면역을 주관하는 림프구의 하나이다. 가슴샘(thymus)에서 성숙되기 때문에 첫글자를 따서 T세포라는 이름이 붙었다. 전체 림프구 중 약 4분의 3이 T세포이다.


mRNA 생산방법
mRNA 개발 방식에는 1)Microfludics와 2)티믹스 방식이 있다. 모더나와 화이자는 제네반트의 LNP를, 그리고 트라이링크의 5’캡핑을 기술이전하여 mRNA 백신을 개발했는데, MF(Microfludics)의 방식을 적용했을 것이라는 판단이다. mRNA를 대량생산할 때에는 Microfludics를 이용하게 되는데, 한쪽에는 LNP원료를 넣고, 다른 한쪽에는 캡핑이 추가된 mRNA를 두어 Y모양의 설비를 구축한다. mRNA백신은 제조과정에서 안전성이 낮은 mRNA분자를 LNP의 지질막으로 캡슐화하고, 보호막 내에서 균일한 상태로 분포시켜야 한다. LNP의 지질막 안에 구성 물질들이 고르게 분산되어 있을 때에 mRNA의 약효가 최대화되고 부작용이 최소화된다고 알려져 있다. mRNA에 많은 관심과 투자가 쏟아진 지금, mRNA 기반의 치료제/백신의 효능을 극대화시킬 수 있는 생산공정도 중요해지고 있기 때문에 Microfludics를 이용한 mRNA 백신 생산법이 많은 주목을 받는 상황이다.
Microfludics (미세유체공학)
매우 작은 공간에서 0.001~0.1초의 순간적인 자연확산 반응을 일으켜 물질을 균일하게 혼합하는 첨단 기술이다.
제네반트 사이언스 (Genevant Science)
스위스 생명공학 회사
트라이링크 (TriLink)
미국 샌디에고에 위치한 mRNA 플랫폼 기반 위탁개발 및 생산업체(CDMO)
5'캡핑 (Five Prime Capping)
쉽게 분해되는 mRNA가 분해되지 않도록 보호하면서 안정적으로 합성하는 기술이다. 이 기술을 적용하면 5프라임 말단에 보호막을 씌워 단백질을 생산하면서 mRNA가 분해되지 않는다.
기존의 방식은 upstream process와 downstream process로 나뉘는데, upstream process는 mRNA의 enzyme(효소)생성으로 이루어져 있고 downsteam process는 mRNA 제품을 정제하는데 필요한 작업이다. 이 두 과정은 LNP 첨가와 Fill-and-finish를 통해 생산과정이 마무리된다. mRNA unit operation(유전자 발현 조정 및 장치 작업)은 mRNA의 사용 목적에 따라 천차만별인데, lab scale생산의 경우 원스텝 합성 반응로 구성된다. unit operation 단계에서 어떤 처리작업을 하느냐에 따라 1)제조가격과 2)도즈 당 가격이 달라지며, mRNA 치료제/백신의 가격 또한 1)도즈당 RNA의 양 2)생산 적정량 3)생산 규모, 또 4)5’캡핑의 가격에 따라 크게 상이한다.
enzyme (효소, 酵素)
기질과 결합해서 효소-기질 복합체를 형성하여 화학 반응의 활성화 에너지를 낮춤으로써 물질대사의 속도를 증가시키는 생체 촉매이다. 그리고 경우에 따라 속도를 조절하는 생체 보호기능을 수행하기도 한다. 효소는 기질을 생성물로 알려진 다른 분자로 전환시킨다. 세포의 거의 모든 대사 과정은 생명을 유지할 수 있을 만큼의 빠른 속도로 일어나야 하기 때문에 효소 촉매작용을 필요로 한다. 대사 경로는 효소에 의존하여 개별 단계들을 촉매한다. 효소에 대해 연구하는 학문을 효소학이라고 하며, 최근에 유사효소(pseudoenzyme) 분석의 새로운 분야가 성장하여 진화 과정에서 일부 효소가 생물학적 촉매 능력을 상실했다는 것을 알게 되었으며, 이는 종종 유사효소의 아미노산 서열과 특이한 유사촉매(pseudocatalytic) 특성에 기인한다.
Fill-and-Finish (무균 충전&포장)
Lab scale (~ 20L 수준, 배양/정제)
치료물질 생산을 위해 배양/정제작업을 진행한다. 치료제 생산 가능여부 또는 세포주 선정 후 수율(단위 부피당 어느 정도 생산이 되는지)을 확인하기 위해 수행한다. 또 비임상이나 초기 임상을 위한 치료제 생산을 진행하기 위해서도 수행한다.
도즈
백신의 1명 접종분량(1회분)을 뜻하는 단위이다. 백신 300 도즈는 300명에게 접종할 수 있는 양이다.

기존 방식은 [그림14]과 [그림15]를 통해 이해할 수 있는데, mRNA의 생산은, 5’캡핑 아날로그가 사용될 경우, 원스텝 효소 합성반응으로 생산이 가능하고, 백신 캡핑 효소를 따로 사용하는 경우 투스텝 합성반응으로 생산된다.

간단하게 설명하자면, mRNA 백신 및 치료제 제조 과정은 1)플라스미드 DNA에서 전사된 mRNA를 합성한 후 2)mRNA제작 과정에서 mRNA의 안정과 효율을 위한 캡(5’ 캡핑기술)을 부착한 후 정제, 그리고 3)LNP를 통한 캡슐화를 진행하여 mRNA를 세포 내에 효과적으로 전달하여 mRNA를 정확하게 충전하고 포장하여 백신/치료제 제품으로 만들어지는 것이다.
플라스미드 DNA (Plasmid DNA, pDNA)
유전자 치료제의 핵심 원료다. DNA 백신 완제품이자, mRNA 백신과 아데노 바이러스, 키메릭항원수용체-T세포(CAR-T) 치료제, 유전자가위 등의 원료로 쓰인다.

그렇다면 글로벌 빅파마들이 관심을 갖고 있고, 생산단가가 상대적으로 저렴한 LNP 대량 생산 시스템은 무엇인가? 했을 때 Microfluidics가 대표적이라 할 수 있다. 앞서 말했듯이, mRNA 대량생산을 위한 설비로 각광받고 있고 캡핑기술을 보유하고 있는 업체에게는 가장 저렴하게 mRNA를 생산할 수 있는 방식이다. 한쪽에는 LNP원료를 넣고, 다른 한쪽에는 캡핑이 추가된 mRNA를 두어 Y모양의 설비를 구축한다.
Part II. RNA 기초: RNAi
RNAi 현상: siRNA
siRNA는 short interfering RNA의 약자로, RNAi(RNA interference, RNA간섭) 현상을 유도하는 RNA이다. RNAi를 일으키는 RNA로는 안티센스 RNA도 있는데, 안티센스 RNA는 mRNA 염기서열에 상보적이어서 mRNA와 염기쌍을 형성하여 단백질 전사를 억제한다. 그러나 안티센스 RNA보다도 특정 유전자의 RNA를 세포에 주입하여도 그 유전자의 발현을 억제할 수 있다는 사실이 피튜니아라는 식물에서 처음 발견되었다.
피튜니아라는 식물의 색은 보라색으로, 더 진한 보라색의 꽃잎을 만들기 위해 보라색 유전자를 피튜니아에 과량으로 집어넣었으나 더 진한 보라색이 아닌 흰색이 나타나는 현상을 발견한 것이 계기가 되었다. 진한 보라색이 아닌 흰색이 희끗하게 나타난 현상은 식물의 ‘공통 억제’현상으로 전사 후에 유전자 silencing(억제, 암묵)이라고 불린다. 이 현상을 RNAi, 단백질이 만들어지지 않도록 mRNA의 발현을 억제하는 현상을 뜻한다.

안티센스 RNA의 억제효과보다 뛰어난 RNAi 현상을 발견 한 후, 예쁜꼬마선충 생식소에 dsRNA를 주입하면 태어난 선충의 태아에서도 dsRNA가 유전되는 것을 확인하고 세포 내 표적 mRNA가 RNAi가 진행되는 동안 없어지는 것을 증명했다.
dsRNA (double-stranded RNA, 이중가닥 RNA)
이후, 초파리에서 Trigger dsRNA를 짧은 조각으로 절단하는 효소를 정제했는데, 이 효소를 Dicer라 한다. Dicer는 siRNA를 생성하는 것으로 알려져 있는데, Dicer dsRNA가 초파리 세포에 들어오면 부분적으로 RNAi를 억제한다. 이는 Dicer 유전자에 대한 RNAi를 이용하여 다른 세포의 RNAi를 막을 수 있게 된다.
세포내에서 siRNA가 유전자 발현을 억제하는 RNAi현상은 암과 감염성 질환, 그리고 다양한 희귀질환과 관련된 유전자를 제어할 수 있다는 점에서 치료제로서의 가능성이 무궁무진하다. RNAi기술은 올리고 핵산 기술로서 질병 단백질에 접근하기가 용이하며 mRNA의 단백질 증폭 기능과는 반대되는 ‘mRNA를 작용하여 유전자/단백질 발현 억제’하는 방식으로 유전자 변이와 같은 작은 단위에서의 세세한 디자인을 가능하게 한다.
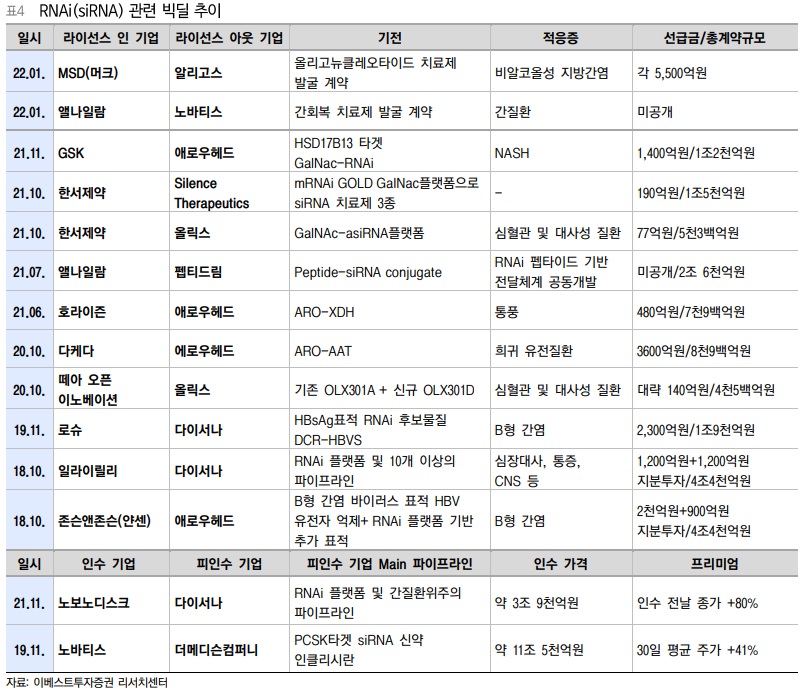
이렇게 세세하고 확실한 유전자 억제 기술인 RNAi는, 2010년 이후 빠른 성장세를 이어오며 연평균성장율 19.8%의 성장성을 지닌 산업이 됐다. 글로벌빅파마들은 RNAi를 기반으로 한 파이프라인에 대한 관심을 ‘라이선싱 딜’로 증명해주고 있으며 코로나19 관련 딜에 집중되어있던 라이선스 딜 추이가 2021년 하반기 이후 RNAi 관련 빅딜이 여러 건 나오며 코로나19 이후의 트렌드로 자리 잡고 있다.
빅딜 (Big Deal)
말 그대로 거대한 거래나 사회적으로 놀랄만한 상황을 뜻한다.

올리고(siRNA원료)의 시퀀스를 바꿈으로써 모든 mRNA를 타겟하는 것이 가능하기 때문에, 구조가 복잡한 단백질의 발현도 억제할 수 있다. 그러나 세포 내로 유입된 siRNA는 면역반응이나 비표적 유전자의 억제 같은 부작용을 일으킬 수 있기 때문에 siRNA를 세포 내로 도입하는 딜리버리 시스템(전달 플랫폼)이 siRNA 기반의 약물/치료제에서 가장 중요한 문제(한계점)로 여겨지고 있다.
올리고뉴클레오타이드 (oligonucleotide)
수 개에서 수십 개의 뉴클레오타이드 단위체가 합성된 중합체를 말한다. '올리고'는 '짧은'이라는 뜻을 가진 접두사이며, 올리고뉴클레오타이드는 인공적인 합성법이 개발되었기 때문에 기업에 의뢰하거나 연구소에서 합성을 하면 원하는 서열의 올리고뉴클레오타이드를 합성하는 것이 가능하다. 이렇게 합성된 올리고핵산의 생물학 및 의학 분야에서의 활용은 매우 다양하다. 올리고핵산은 안티센스로 사용이 되거나, DNA 합성을 위한 프라이머 합성 및 확장, 상보작인 서열의 탐색, 돌연변이나 제한 부위의 탐색, 인공 유전자 합성 등으로 사용될 수 있다.
siRNA 선두: 앨나일람의 GalNAc
그동안 siRNA와 같은 RNAi기반 치료제는 유전물질 전달에 어려움이 있어, RNAi가 발견되어 2006년 노벨 생리의학상을 받고 2018년도까지 신약개발이 되지 않았었다. RNAi(siRNA)의 선두주자인 앨나일람은 GalNAc 접합 전달기술을 통해 효과적인 피하주사로 치료를 가능하게 했다.
앨나일람은 세계 최초의 siRNA 치료제 온파트로를 2018년 8월, 유전성 트랜스티레틴 매개성 아밀로이드증(ATTR) 성인환자의 다발신경병증에 대한 치료제로 승인받았다. FDA 국장은 승인 당시 “이 승인은 질병 진행을 늦추거나 증상을 치료하는데 그치는 것이 아니라, 근본적인 질병 원인을 실제로 표적으로 삼고 치료할 수 있게 하는 광범위한 발전 흐름의 일부이다” 라고 말하며 RNAi치료제 기술을 호평했다.
ATTR 아밀로이드증
잘못접힌(misfolded) 트렌스티레틴(transthyretin, TTR) 단백질로 인해 심장과 신경조직 등 장기에 아밀로이드가 축적되는 치명적인 희귀질환이다.
온파트로는 LNP를 이용한 최초의 RNAi치료제이며 앨나일람은 이후에 RNAi기반의 기술에 GalNAc(conjugate, 링커)기술을 적용시켜 기브라리, 옥슬루모, 그리고 렉비오를 개발하거나 시판하는 데 성공했으며 2022년 JP모건에서 3년간 4가지 약물을 출시할 예정이라 언급하며 siRNA의 선두주자로서 계속되는 시장 개척을 보이고 있다.
GalNAc (N-acetylgalactosamine, N-아세틸갈락토사민)
갈락토스의 아미노당 유도체이다. 사람에서 N-아세틸갈락토사민은 ABO식 혈액형의 A형 혈액형의 항원을 형성하는 말단 탄수화물이다.
RNAi가 치료제로서 무궁무진한 가능성을 보였음에도 RNAi의 사이즈(~14,000Da)와 40개의 음전하 인산염(phosphate)때문에 siRNA(RNAi)기반의 약물은 자체적으로 세포를 투과하기 힘들다. 이에 덧붙여, 네이키드 siRNA는 RNAses(RNA분해효소)에 의해 혈액에서 쉽게 분해되며 간 청소 수용체(scavenger receptor)에 의해 흡수되기 때문에 약물/치료제로서의 유효성이 떨어졌던 것이다. siRNA의 backbone(뼈대)은 인산염이기 때문에 음전하를 띈다고 앞서 말했는데, siRNA의 한계점(효소 영향과 불안정한 구조)을 이겨내기 위해서 siRNA의 구조를 조정하거나 backbone을 변형(2’-OH를 2’-OMe, 2’-F로)하는 방식이 사용되고 있으며, 전달 체계로서는 GalNAc이 가장 획기적이라는 평가를 받고 있다.
Da (dalton, 돌턴)
원자나 분자 따위의 질량 표준 단위이다(원자 질량). 1 원자 질량 단위는 대략 핵자 하나의 질량이고 수치적으로 1 g/mol과 동등하다.
인산염 (燐酸鹽, phosphate)
인산의 염을 가리키는 무기 화합물이다. 하나의 인과 4개의 산소로 구성된 다원자 이온 또는 근본 물질에서 형성된 물질이다. 인산 이온(phosphate ion)은 −3 값의 전하를 가지고 PO₄³⁻로 써서 나타낸다. 다시 말해 인산에 있는 수소 이온을 금속 이온 따위의 양이온으로 치환한 염을 가리킨다. 인산염을 이용하면 농업과 공업에 쓰이는 인을 얻을 수 있고, 식품 첨가물로도 사용된다.

GalNAc은 간세포 표면의 ASGPR를 인식해 siRNA가 세포 내 유입을 유도하는 표지이다. 3개의 GalNAc(N-acetylgalactosamine)분자를 siRNA에 연결, 간에 다수 존재하는 수용체인 ASGPR에 결합하여 세포 내 이입으로 siRNA를 전달하는 방식이다. 생체 내에서 충분한 양의 siRNA를 표적 세포에 선택적으로 전달할 수 있다는 장점을 갖고 있다. RNA간섭 분야 부동의 1위인 앨나일람의 GalNAc적용 사례를 바탕으로, 애로우헤드와 다이서나, 그리고 더메이슨 컴퍼니까지 글로벌 탑티어 RNAi 기술을 가진 기업들이 GalNAc을 도입시켜 파이프라인 개발을 박차고 있다.
ASGPR (asialoglycoprotein receptor)
애로우헤드 파마슈티컬스 (Arrowhead Pharmaceuticals)
미국 바이오제약기업
다이서나 파마슈티컬스 (Dicerna Pharmaceuticals)
미국 매사추세츠주 캠브리지에 소재한 RNA 간섭(RNAi) 기술 기반 치료제 개발 전문 제약기업
siRNA의 확장성: 간위주의 희귀질환 → 만성질환 그리고 더 큰 시장으로
GalNAc의 도입으로 siRNA를 이용한 간질환 타겟팅이 수월해졌고, 최초의 siRNA치료제(온파트로) 이후 시판된 siRNA 약물 ‘기브라리(Givlaari, givosiran)’, ‘옥슬루모(Oxlumo, lumasiran)’, ‘렉비오(Leqvio, inclisiran)’는 모두 GalNAc기술이 적용되었다. 기브라리(앨나일람)는 급성 간성 포르피린증을 적응증으로 하는 약물로, 간에서 포르피린 또는 그 전구물질이 과잉 발현되어 축적되고 그 결과 포르피린성 발작을 일으키는 질병이다. 유전성 포르피린증은 전 세계 환자수가 약 4,000명 정도인 희귀질환이다. 옥슬루모(앨나일람)는 원발성 옥사산뇨증 1형을 치료하는 약물로, 글리콕실레이트 대사의 이상으로 인한 옥살산 과다분비가 비뇨기계에 생기는 문제를 옥살산 생산 억제를 톡해 막아준다.
포르피린
헤모글로빈이 철분과 결합할 수 있도록 도와주는 단백질이다. 포르피린은 적혈구의 혈색소에 많이 포함되어 있으며, 헤모글로빈 합성에 중요한 역할을 한다. 이 포르피린을 혈색소로 바꾸기 위해 특정한 효소가 필요하다. 그 과정에서 선천적 혹은 후천적인 유전자의 결함으로 효소가 결핍되면 포르피린 과다 축적이 일어나 신체에 이상이 나타난다. 이러한 질환을 포르피린증이라고 한다.
전구물질 (전구체, precursor, 선구물질)
화학에서 다른 화합물을 생성하는 화학 반응에 참여하는 화합물이다. 예를 들면, 베타카로틴은 비타민 A의 전구체이다.
기브라리와 옥슬루모는 희귀질환을 타겟하는 약물이었던 반면에, 2021년 12월 FDA승인을 받은 렉비오(인클리시란, 노바티스)는 고콜레스테롤혈증 및 이상지질혈증을 적응증으로하는 만성질환 약물이다. 렉비오(인클리시란)은 앨나일람이 메디슨즈 컴퍼니와 공동개발하던 약물인데 2019년 11월 노바티스가 메디슨즈 컴퍼니를 인수하면서 현재 노바티스가 모든 권리를 갖고 있다(앨나일람은 마일스톤과 로열티). 렉비오의 FDA승인은 만성질환으로 siRNA가 첫걸음을 내디딘 유의미한 결과물로, 희귀질환을 타겟으로 하던 기존의 약물의 한계점을 뛰어넘은 것이다.
더 메디슨스 컴퍼니 (The Medicines Company)
미국 뉴저지주 파시파니에 소재한 응급‧집중 치료제 전문 제약기업
마일스톤 (milestone)
신약 라이선스 계약은 대부분 마일스톤 방식으로 이뤄지며, 계약 체결 후 받는 계약금, 개발 단계별 성취도에 따라 받는 단계별 기술료로 구성된다. 제품 상용화 이후에는 마일스톤과 별개로 판매액 일정비율의 로열티를 받는다. 마일스톤의 단계별 기술료 세부내역은 치열한 시장 경쟁 상황 등을 고려해 계약 당사자들간 협의에 따라 통상적으로 비공개로 한다.
Arrowhead Pharmaceuticals의 siRNA치료제 ARO-APOC3도 트라이글리세이드 과잉 고지혈증(타겟 환자 6천만명)을 적응증으로 임상3상을 진행중이다. Vir biotechnology는 앨나일람에서 도입한 HBV(만성 B형 간염) siRNA치료제를 개발중(임상2상)에 있으며, 단독투여뿐만이 아니라 병용투여(항체치료제)를 시도하는 등 다양한 병용 임상까지 진행 중이다. HBV시장은 간 질환 중 압도적으로 큰 시장으로, 전 세계 환자가 약 3억명이며 만성질환이기 때문에 내성이 생기기 쉽다. 현재까지 나온 약물/치료제로는 완치율이 5-7%정도 밖에 되지 않아, 미충족 수요가 매우 큰 시장이기도 하다.
HBV (Hepatitis B virus, B형 간염 바이러스)
부분 이중 가닥 DNA 바이러스이자 오르토헤파드나바이러스속의 종이며 헤파드나바이러스과에 속한다. 이 바이러스는 B형 간염을 일으킨다.
전 세계적으로 간 위주의 만성질환 포트폴리오 다각화도 진행 중이지만, 제약바이오산업에서 가장 관심과 투자를 많이 받는 항암분야와 치매(+뇌질환)분야에서도 다양한 연구개발이 진행중이다. 앨나일람은 2022년 상반기에 치매치료제 임상1상 진입을 계획 중인데, 뇌질환(CNS)으로는 C16 conjugate(전달체)을 처음으로 시도하는 바이며 C16는 타노 꼬리 길이가 16개인 지질(lipid)이다. GalNAc을 대신하여 C16을 siRNA약물 말단에 붙여 원하는 타겟으로 전달하는 방식이다.
항암분야로는 이미 알려진 암 특이적 유전자들을 RNAi기술로 억제하여 암세포의 성장과 증식, 그리고 전이에 대해 부작용 자체를 최소화하면서 치료를 가능하게 할 수 있다. 난치성 또는 재발성 고형암 환자에 대해 질병이 나타나기 전 유전자 단계에서 질병 단백질이 발현되는 것을 막거나 종양 유전자의 특성을 파악한다.
siRNA 전달이 관건: NEXT-GalNAc
앞서 말했듯이, GalNAc의 도입으로 siRNA의 오프타겟 이슈가 해결되는 듯하였으나, GalNAc의 특성상 siRNA분자에 연결하면 간에 많이 존재하는 ASGPR가 GalNAc분자를 인식해 치료제가 간을 타깃하는데에 그친다는 한계점을 마주했다. 그렇다면 siRNA 시장에서는 GalNAc과 더불어 NEXT-GalNAc을 찾는 것이 관건이라는 판단이다. 간세포 이외의 세포에 특이적으로 전달하려고 주로 시도되는 방법은 GalNAc과 같은 바이오 물질을 화학적으로, 혹은 링커를 접목시켜 siRNA에 접합시키는 것이다.

최근 GalNAc의 최초 도입자 앨라일람은 GalNAc의 간 타겟 한계점을 넘기위해 펩타이드 기반의 전달체계 개발을 진행중이다. 앨나일람은 일본 펩티드림과 간 외부 조직에 RNAi 치료제를 전달하기 위한 여러 기회를 창출하기 위해 펩티드-siRNA 접합체를 발굴하고, 개발하는 라이선스(및 제휴)계약을 체결했다. 이 제휴를 통해 펩티드림과 앨나일람은 표적 세포에 발현되는 수용체와의 상호작용을 통해 간 외부 조직에 siRNA분자를 전달하는 펩티드를 선택하고 최적화하게 된다. 앨나일람은 펩티드림의 펩타이드 기반 기술을 접목시키기 위해 계약금 및 연구자금을 지급한다. 선급금은 비공개이지만 개발, 허가 및 상업화 마일스톤은 총 22억달러에 한자릿수 로열티로 합의했다.
펩타이드 (peptide)
아미노산의 중합체이다. 보통 소수의 아미노산이 연결된 형태를 펩타이드라 부르고 많은 아미노산이 연결되면 단백질로 부른다. 이러한 펩타이드 및 단백질 구조에서 아미노산 간의 연결은 아미드 결합 또는 펩타이드 결합으로 이루어져 있다. 펩타이드 결합이란 카르복실기(-COOH)와 아미노기(NH2-) 사이에 물이 빠져나가고 -CO-NH- 형태를 이루는 결합이다.
펩티드림 (PeptiDream)
일본의 펩타이드 발굴회사
펩타이드를 이용한 siRNA 전달체계 말고도 엑소좀을 이용한 전달도 눈에 띈다. 최근 엑소좀은 전신 RNAi 전달을 위한 전달체로서 가능성을 보여주고 있다. 엑소좀은 내인성 세포에 의해 생성된 천연 나노입자로 miRNA나 siRNA같은 물질을 말단 조직으로 운반한다. 식세포 작용으로부터 세포를 보호하는 기능을 갖고 있는 CD47과는 다르게, 내인성 신호 라이간드가 포함되어 있어서 세포 흡수를 개선하고 전신 순환 반감기를 증가시킬 수 있다. 대표적으로 Codiak Biosciences가 면역종양과 자가면역 표적을 위한 엑소좀 기반의 siRNA를 개발중에 있고, MD앤더슨 암센터 또한 췌장암에 대한 엑소좀 기반의 anti-KRAS siRNA를 시험하는 임상을 등록했다.
엑소좀 (Exosome)
세포 간 정보교환을 위해 분비하는 나노 사이즈의 막구조를 가진 소포체. 막단백질의 운반체로 유용하다.
식세포 작용 (식작용, phagocytosis)
세포생물학에서, 생존하는 식세포가 체내의 이물질, 외부에서 들어온 바이러스나 세균 따위를 섭취하여 이들을 제거하는 작용이다. 과립 백혈구가 항원을 잡아먹어 세포 내 소화를 통해 파괴하는 방법으로 항원을 제거하는 일종의 면역 반응이다. 식균 작용, 식세포활동이라고도 한다. 식작용은 고체 물질을 세포 안으로 유입하는 세포내이입(또는 세포내섭취, endocytosis)의 한 형태이므로 액체 물질을 세포 안으로 유입하는 음세포작용(pinocytosis)과는 구별된다. 식작용은 일부 세포에 대해 영양분을 취득하는데 기여하며 면역계에서 병원체와 세포 찌꺼기를 제거하기 위한 주된 매커니즘이다. 식작용을 하는 세포로는 대식세포(macrophage), 호중구(neutrophil), 호산구(eosinophil) 등이 있다.
Codiak Biosciences (코디악 바이오사이언스)
미국의 엑소좀 치료제 개발 회사
MD앤더슨 암센터 (M.D. Anderson 암센터)
미국 텍사스 의과대학 부속 의료기관의 일원으로서 암 환자의 치료, 연구, 교육 및 예방에 전념하는 세계적으로 가장 인정받는 암 센터이다.
계속되는 GalNAc기반의 RNAi치료제의 승인은 이제 간 이외 다른 기관들에도 특이적으로 작용하는 치료제의 개발이 확장되고, 활발해질 수밖에 없는 상황을 뜻한다. RNAi는 원하는 유전자를 억제시킬 수 있기 때문에 기존의 안티센스나 리보자임대비 치료제로서의 업사이드가 크다.
안티센스 치료법
RNA(리보핵산)을 통해 질병 진행과정에 연관된 단백질을 타깃으로 하는 치료법으로, mRNA(messenger RNA)를 제거해 질병을 유발하는 단백질의 생산을 저해하는 기전을 갖고 있다. 즉 기존 합성의약품과 바이오의약품이 질병의 진행 과정에서 특정 단백질을 타깃으로 하는 반면 안티센스 치료법은 mRNA를 제거함으로써 단백질의 합성을 예방할 수 있다.
리보자임 (Ribozyme)
효소처럼 작용하는 RNA 분자로서 RNA(Riboneucleic Acid)의 'Ribo'와 효소(Enzyme)의 'zyme'의 합성어이다. 최초 용어 사용은 자기 자신에게 작용하는 RNA 촉매를 발견하고 리보자임이라고 명명한 토머스 체크이다.
RNAi 현상: miRNA
miRNA는 마이크로, 혹은 미니 RNA로, 글자 그대로의 22개 리보뉴클레오타이드로 이루어진 작은 RNA다. miRNA는 siRNA와 같이 다른 mRNA와 결합함으로써 특정 단백질을 만들지 못하게 하는 작용을 한다. 약1,000가지의 miRNA가 존재하며 대부분의 단백질 합성 유전자를 통제한다. 자체적으로 생성된 miRNA는 매우 짧기 때문에 수백 개의 타겟 유전자와 상보적인 염기서열을 이룬다는 뜻이며, 생물의 과정 하나하나에 영향을 미칠 수 있다. 그러나 miRNA는 온-오프 스위치가 아니라 타겟 단백질 발현의 튜닝을 통해 몇 개의 miRNA들이 공통의 타겟 유전자를 조절하기도 하며 서로 기능이 섞여 타겟 유전자를 동시에 조절하는 효과를 내기도 한다.

최근에는 면역시스템에 영향을 미치는 다양한 miRNA들과 타겟 유전자들이 밝혀졌지만, key miRNA를 찾아내어 확실한 유전자 타겟을 밝혀내는 것은 여전히 어렵다. 특히 성숙 T 림프구는 뉴클레오타이드 삭제 및 삽입과 같은 현상이 자주 일어나 개인 별로 성숙 miRNA의 시퀀스가 매우 다르기 때문이다. 그러나 글로벌 제약사들이 암이나 자가면역질환에서 발견된 miRNA로 다양한 질환의 진단마커(바이오마커)로서 활용이 가능하다고 판단하고 있기 때문에 최근에 많은 관심이 집중되고 있다. 실제로 항암효과를 가진 miRNA를 쥐에 주입했을 때, 폐암을 치료하는 시도가 꾸준히 이루어지고 있다.
항암분야와 자가면역질환 이외에 단일물질로 miRNA을 억제하여 퇴행성 뇌질환과 다양한 인자를 동시에 조절해 치료하는 기술을 기반으로 하는 국내 바이오텍 바이오오케스트라가 글로벌 관심을 받으며 miRNA 같은 생체표지자기반 RNA치료제와 전달체를 개발 중이다. 바이오오케스트라가 주목한 miRNA 바이오마커는 miRNA-485-3p인데, 알츠하이머 환자들의 뇌조직에서 공통적으로 miRNA-485-3p의 발현율이 높은 것이 확인되었고 해당 바이오마커를 정상세포에 주입 할 시에 병리단백질이 생성되며 조기진단과 miRNA-485-3p에 결합하는 유전자간섭의 합성을 증명해냈다.
바이오오케스트라 (biorchestra)
RNA 기반 뇌질환 치료제 개발기업
Part III. 결론 및 기업분석
RNA기반 제약바이오 산업에 Overweight 제시
2022년 제약바이오 업종 중 RNA 기반의 기술 의견에 Overweight를 제시하고, 최선호주로 관련 해외 기업 Alnylam Pharmaceuticals 를 제시한다. RNAi 뿐만이 아니라 mRNA 기반의 파이프라인 급증으로 국내 최대 CDMO/CMO기업인 삼성바이오로직스의 커버리지를 개시하며 글로벌 빅파마의 선택을 받은 해외 RNA 관련 기업들의 동향과 추이를 살펴보았다.
Overweight (비중확대)
삼성바이오로직스
삼성그룹의 계열사로 2011년 4월 설립되었으며, 국내외 제약회사의 첨단 바이오의약품을 위탁 생산하는 CMO 사업을 영위. 2018년 cGMP 생산을 시작하여 2019년말 기준 36.2만리터 생산설비를 가동 중이며, 이 시장에서 선발업체를 추월해 생산설비 기준 세계 1위 CMO로 도약. 동사의 바이오의약품 연구개발 자회사인 삼성바이오에피스와 아키젠바이오텍은 바이오시밀러 개발 및 상업화를 진행 중.
출처 : 에프앤가이드
커버리지 (coverage)
애널리스트가 특정 종목에 대한 분석 보고서를 발행하고, 지속 발행할 예정.
글로벌 빅파마의 관심과 투자를 가장 많이 받고 있는 RNA 기반 기술로는 RNAi 중에서도 siRNA가 대표적이었고, 코로나19로 인해 상용화가 앞당겨진 mRNA가 근 2년간 가장 많은 파이프라인 증가 추세를 보이고 있다. 글로벌 바이오 트렌드는 곧 우리 기업의 바이오트렌드다, 이번 인뎁스에서는 국내 mRNA 대표 CDMO 삼성바이오로직스와 미국 대표 RNAi 기업 앨나일람을 제시했지만 국내외 바이오텍과 빅파마와의 딜 증가로 바이오텍에 대한 관심을 높여야 할 때이다. 혁신적인 신규 모달리티만이 새로운 시장과 신약을 개척할 수 있다.

코로나19로 인해 바이오/의료에 대한 투자와 관심이 급증했으며 그로 인한 각국의 정책과 정부의 지원 또한 증가하는 추세인데, 코로나19 이후 현금이 쌓인 기업들(화이자, 머크, 노바티스 등)은 신성장동력 찾기에 한창이다. 이와 더불어 해외 선두기업들의 동향을 살펴 차후 관련기술의 트렌드가 어떤 방향성을 갖고 성장해나가는지, 지금의 한계점을 이겨낼 방법은 무엇인지를 찾아내는 것이 관건이다. RNAi를 선두하는 앨나일람이 LNP보다는 GalNAc을 접목시켜 치료제로 개발을 활발히 하면서도 새로운 전달체계에 대한 투자와 만성질환 위주의 포트폴리오를 구축하려는 것과 같이 mRNA에서는 코로나19를 기점으로 감염병과 바이러스 기반의 인플루엔자는 물론, 개인맞춤형 항암백신에 대한 활발한 투자에 주목해야 한다.
머크 (Merck Sharp & Dohme)
미국의 제약 회사이다. 미국 및 캐나다 내에서는 머크 앤드 컴퍼니(Merck & Co)라는 이름으로 등록되어 있다.
파이프라인 옥석 가리기가 힘들다면, 국내 기업들 중에서 코로나19의 수혜를 받은 기업 중 CMO/CDMO 사업을 영위하는 기업들 또한 좋은 결과를 낸 덕분에 브랜드 밸류가 생성된 상황이다. 이를 기반으로 글로벌 빅파마들과의 지속적인 수주와 계약이 증가할 것이며 커지는 바이오의약품과 유전자/세포치료제 시장에서의 CDMO 트렉레코드는 부지확보와 증설에 대한 선제적 투자가 관건이다.
브랜드 밸류 (브랜드 가치)
22/02/14 이베스트증권 Analyst 강하나
마치며
RNA 관련해 나름 쉽게 설명하려 하신 듯한데 기초지식이 없으면 어렵게 느껴지는 건 매한가지 일 것 같네요. 아무튼 글로벌 빅파마들도 RNA에 대해 관심이 높기에 꾸준히 관심을 가져보면 좋을 것 같습니다.
끝으로 Alnylam Pharmaceuticals, 삼성바이오로직스 기업리포트도 있으니 관심 있는 분들은 찾아보셔도 좋을 듯합니다.
감사합니다. 오늘도 많이 배우고 갑니다.😊
'리포트 > 제약ㆍ바이오' 카테고리의 다른 글
| (리포트 뜯어보기)[지니너스] 윤석열 헬스케어: 디지털 헬스케어 (0) | 2022.03.14 |
|---|---|
| (리포트 뜯어보기)[녹십자] IVIG-SN 10%, FDA CRL 수령 (0) | 2022.03.02 |
| (리포트 뜯어보기)[대웅제약] 2022년도에도 이어질 호실적 시현 (0) | 2022.02.18 |
| (리포트 뜯어보기)[제이시스메디칼] 2022년에도 빛날 미용 의료기기 업체 (0) | 2022.02.04 |
| (리포트 뜯어보기)[엠아이텍] 구조적 성장이 기대되는 의료기기 강자 (0) | 2022.01.19 |

